آنزیم ها در بدن موجودات زنده عملكردهای مهمی را برعهده دارند. چنان كه به عنوان كاتالیزگرهای زیست شیمیایی اثرهایی ویژه از خود به نمایش می گذارند. هم چنین بسیاری از بیماری های مربوط به ژن ها می تواند ناشی از وجود یا نبودن یك یا چند آنزیم باشد. به این ترتیب مطالعه ی آنزیم ها و اندازه گیری فعالیت آن ها در پلاسما، سلول های سرخ رنگ یا نمونه ی بافت ها در تشخیص برخی بیماری ها از اهمیت ویژه برخوردار است.
آنزیم ها در بدن موجودات زنده عملكردهای مهمی را برعهده دارند. چنان كه به عنوان كاتالیزگرهای زیست شیمیایی اثرهایی ویژه از خود به نمایش می گذارند. هم چنین بسیاری از بیماری های مربوط به ژن ها می تواند ناشی از وجود یا نبودن یك یا چند آنزیم باشد. به این ترتیب مطالعه ی آنزیم ها و اندازه گیری فعالیت آن ها در پلاسما، سلول های سرخ رنگ یا نمونه ی بافت ها در تشخیص برخی بیماری ها از اهمیت ویژه برخوردار است.

آنزیم ها كاتالیزگرهای پروتیینی هستند كه توسط سلول زنده ساخته می شوند و كاتالیز واكنش های زیست شیمیایی را در درون و بیرون از سلول به عهده دارند تا جایی كه سرعت واكنش ها را به حدود 107 برابر افزایش می دهند. در سلولی كه دمای آن بالاست یا كاتالیزگر در آن حضور ندارد، واكنش ها با سرعت كمی پیش می روند چرا كه بیش تر مولكول ها انرژی جنبشی مورد نیاز برای گذر از سد انرژی را در اختیار ندارند.
ساختار آنزیم ها
سه نوع ساختار به این تركیب های پروتیینی نسبت داده می شود كه به این قرارند:
√ساختار نوع اول؛ كه به ترتیبِ قرار گرفتن آمینو اسیدها در یك زنجیره ی پلی پپتیدی گفته می شود. در واقع، پایه ی ساختار اولیه ی آنزیم، پیوندهای پپتیدی هستند. گفتنی است كه معمولاً آلفا آمینواسیدها در این زنجیره حضور دارند.
√ ساختار نوع دوم؛ در این ساختار، پروتیین ها به شكل كروی ولی در دو حالت، یكی حالت مارپیچی آلفا كه راست گردان است و دیگری صفحه های چین دار كه با پیوندهای هیدروژنی درون مولكولی پایدار می شود مشاهده می شوند.
√ ساختار نوع سوم؛ پرولین، آمینو اسیدی است كه حضور آن در پروتیین سبب می شود ساختار مارپیچی آلفا نظم خود را از دست بدهد و دچار خمیدگی شود. وجود چند مولكول از این آمینواسید در زنجیره ی پلی پپتیدی، سبب خمیده شدن این زنجیره در مكان های مختلف می شود و در نتیجه پروتیین، ساختار سه بعدی پیدا می كند. درا ین جا، پیوندهای هیدروژنی، پیوندهای یونی و پیوندهای آب گریز درون مولكولی به این ساختار پیچ خورده و كلاف مانند، پایداری می بخشند.
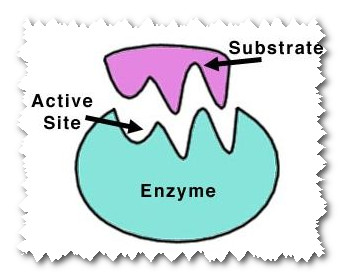
جایگاه فعال
بنا به نظریه ی كوشالند، در مولكول های پروتیینی و بزرگ آنزیم ها، جایگاه ویژه ای جهت پذیرش پیش ماده وجود دارد. در این جایگاه، آمینو اسیدهایی ویژه در نتیجه ی نزدیكی با یك دیگر، نقش كاتالیزگر را از خود نشان می دهند.
تنها زمانی كه پیش ماده ای در كنار جایگاه فعال قرار گیرد، عوامل مؤثر در این جایگاه ها خاصیت كاتالیزگری پیدا می كنند. در این حال، نزدیكی با پیش ماده، سبب تغییراتی در ساختار فضایی آنزیم می شود و در پی آن، آمینواسیدها در بهترین وضعیت نسبت به پیش ماده قرار می گیرند تا عمل كاتالیز را انجام دهند.
پایداری آنزیم
با این كه كاتالیزگرها در واكنش های شیمیایی باید بدون تغییر باقی بمانند، اما پایداری آنزیم ها به شرایط وابسته است چنانكه گاه این پایداری را از دست می دهند. به دیگر سخن، ساختار فضایی آنزیم دچار دگرگونی می شود و تغییر در ساختار نوع دوم و نوع سوم، به از دست رفتن فعالیت زیست شناختی آنزیم می انجامد.
پژوهشگران بر این باورند كه افزایش آنتروپی نه تنها سبب باز شدن زنجیره های پلی پپتیدی می شود بلكه عامل اصلی ناپایداری پروتیین های كروی نیز هست. ، كه اختلاف انرژی حالت پیچ خورده و حالت باز شده ی پروتیین محلول است، بی آن كه دستخوش فرایند واسرشتی شود، یكی از فراسنج های مهم در پایداری پروتیین به شمار می رود. بر این اساس یكی از روش های معمول جهت پایدار كردن آنزیم ها، جایگزین كردن آمینواسیدهایی است كه آنتروپی ساختار بازشده ی پروتیین را كاهش دهند.
برای نمونه، جایگزین كردن گلیسین به جای آلانین در لیزوزیم T ، بر پایداری این پروتیین می افزاید.
پروتیین ها در جریان فرایندی به نام واسرشتی، برخی از خواص فیزیكی، همچون انحلال پذیری را در كنار فعالیت های زیستی خود از دست می دهند. در واقع، دراین فرایند، تخریب فیزیكی ساختار سه بعدی پروتیین روی می دهد كه بر عملكردهای آن اثر می گذارد. عواملی همچون گرمای زیاد، pH نامناسب و موادی مانند اوره و پاك كننده ها حالت واسرشتی را در مولكول پروتیین پدید می آورند. در ادامه، اثر این عوامل بررسی می شود.
گرما
روی هم رفته، سرعت واكنش های شیمیایی با افزایش گرما فزونی می یابد. در واكنش های آنزیمی نیز افزایش گرما تا حدود 50C ، افزایش سرعت واكنش را در پی دارد. اما دماهای بالاتر سبب دگرگونی ساختار آنزیم و در نتیجه غیرفعال شدن آن می شود. معمولا در دمای 70 تا 80 درجه ی سلسیوس آنزیم ها غیرفعال می شوند.
مقدار pH
اسیدها و بازها با مولكول پروتیینی آنزیم، پیوند یونی برقرار می كنند. اگر این پیوند خیلی قوی باشد پروتیین ماهیت خود را به گونه ی برگشت ناپذیر از دست می دهد.
نمودار تغییرات فعالیت آنزیم برحسب تغییرات pH دارای ماكزیممی است كه به آن نقطه ی pH بهینه گفته می شود و مقدار آن نشان دهنده ی دامنه ای از pH است كه آنزیم در آن، بیش ترین فعالیت را از خود نشان می دهد. معمولا این دامنه، مقدار 5 pH تا 9 را دربرمی گیرد.
غلظت
تا زمانی كه پیش ماده، به عنوان واكنشگر اضافی به مقدار كافی در محلول وجود داشته باشد، سرعت واكنش آنزیمی به غلظت آنزیم وابسته است. چنان چه غلظت آنزیم به مقدار چشم گیر افزایش یابد سرعت واكنش به علت كم بودن پیش ماده، افزایش می یابد.
منبع:رشد


 مقاله شیمی کوپلیمریزاسیون
مقاله شیمی کوپلیمریزاسیون 
